Jeśli masz te wspólne leki od Walmart lub Walgreens, nie bierz ich, FDA ostrzega

Aby zwalczyć wspólne bóle, ból. Prawdopodobnie masz pod ręką TUMS w przypadku rozstroju żołądka i środka przeciwbólowego, takiego jak Tylenol lub Advil do leczenia nagłego bólu głowy. Często najwygodniejsze i najbardziej przystępnymi detaliistami do kupowania tych produktów są lokalne sklepy Walgreens lub Walmart. Ale u.S. Food and Drug Administration (FDA) właśnie wydało ostrzeżenie o jednym leku bez recepty (OTC), które mógłbyś kupić w dowolnym łańcuchu, i będziesz chciał przestać natychmiast używać. Czytaj dalej, aby dowiedzieć się, które wspólne leki są teraz przedmiotem przypomnienia.
Przeczytaj następną: jeśli weźmiesz te leki przeciwbólowe, przestań teraz, FDA ostrzega.
Niedawno odwołano kilka leków OTC.
Niestety, najnowsze wycofanie nie jest izolowane, ponieważ inne leki zostały wyciągnięte z półek sklepowych tego lata. 9 czerwca FDA ogłosiła, że Green Pharmaceuticals Inc. Czy dobrowolnie przywołał niektóre produkty Nasospray Serorestop po odkryciu, że zostały zanieczyszczone Providencia rettgeri Bakterie, stanowiące poważne zagrożenie dla zdrowia osób z obniżoną odpornością. I zaledwie dwa dni wcześniej, 7 czerwca, FDA potwierdziła, że Buzzagogo Inc. dobrowolnie przypominał jedną partię jej alergicznej pszczoły zniknięte do dzieci zaradczy z wymazu nosowego po tym, jak testy FDA stwierdzono wyższe niż akceptowalne poziom.
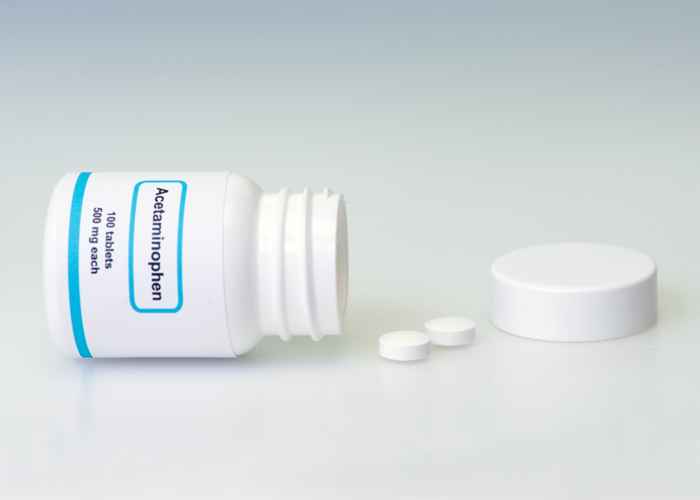
Jeszcze bardziej powszechne przywołanie miało miejsce 16 czerwca, kiedy U.S. Komisja ds. Bezpieczeństwa produktów konsumenckich (CPSC) ogłosiła wycofanie dwóch rodzajów marki Kroger Acetaminophen i jednego rodzaju acetaminofen z marki sklepowej Walgreens, który naruszył Ustawę o pakowaniu zapobiegania zatruciom (PPPA). Teraz FDA wydała ostrzeżenie o kolejnym leku OTC, który również znalazł się na pierwszych stronach gazet w zeszłym miesiącu.
Istniejące wycofanie zostało rozszerzone o więcej produktów.

14 lipca Vi-Jon LLC ogłosił, że rozszerzy się dobrowolne wycofanie soli fizjologicznej cytrynowej przeczyszczającego doustnego smaku cytrynowego roztworu cytrynowego cytrynowego magnezu. Produkty były dostępne w 10-płynnej uncji przezroczystej, okrągłej plastikowej butelki i są używane do od czasu do czasu złagodzenia zaparć. AE0FCC31AE342FD3A1346EBBB1F342FCB
Firma wydała już dobrowolne wycofanie 21 czerwca, ale ograniczono ją do jednej partii CVS cytrynowego soli fizjologicznego smaku doustnego smaku cytryny CVS Cytacyjny roztwór cytryny wyprodukowany przez Vi-Jon LLC. Teraz wycofanie zostało rozszerzone o wszystkie wiele leków wyprodukowanych w Vi-jon w Smyrna, Tennessee, na poziomie konsumenckim.
Według ogłoszenia, w tym Walgreens, Walmart, CVS, Rite Aid, Publix, Publix, Kroger i Harris Teetler, w tym do sprzedaży hurtowej i handlowej, w tym do hurtowych. Pełna lista dotkniętych nazw marki, krajowych kodów leków i uniwersalnych kodów produktów są wymienione w ramach ogłoszenia wycofania.
Powiązane: Aby uzyskać więcej aktualnych informacji, zapisz się do naszego codziennego biuletynu.
Stwierdzono, że produkty zawierają niebezpieczne bakterie.

Zgodnie z ogłoszeniem wycofania, testowanie przez stronę trzecią i vi-jon zidentyfikowało obecność Gluconacetobacter kaczek, mikroorganizm, który może powodować infekcje inwazyjne. Pacjenci z obniżoną odpornością mają większe ryzyko zakażenia, jeśli spożywają zanieczyszczone produkty, potencjalnie prowadząc do „poważnych, zagrażających życiu konsekwencji zdrowotnych."
Od 14 lipca firma otrzymała jeden raport z reakcji, który mógłby być powiązany z wycofanymi produktami, a Vi-jon jest obecnie „w trakcie badania tego raportu."
Przestań używać tego produktu natychmiast, jeśli masz go w domu.

Jeśli weźmiesz jedną z tych przeczyszczających marek w celu leczenia nieprawidłowości, FDA ostrzega. Vi-jon również dociera do klientów bezpośrednio przez telefon lub e-mail, aby zorganizować zwrot lub zniszczenie wycofanych produktów.
Powinieneś skontaktować się ze swoim dostawcą opieki zdrowotnej lub lekarzem, jeśli doświadczysz jakiekolwiek niepożądane reakcje po przyjęciu tego produktu, a FDA prosi również o zgłaszanie tych problemów i problemów z jakością jego programu raportowania zdarzeń niepożądanych MedWatch. Możesz to zrobić online lub pobrać formularz, aby wypełnić i wysłać pocztą lub faksem z powrotem do agencji.
Klienci z pytaniami mogą skontaktować się z vi-jon e-mailem na [e-mail chroniony], od poniedziałku do piątku, między 7:30 a.M. i 4:30 s.M. Czas centralny.


