Jeśli używasz tego codziennego leku, FDA ma pilne nowe ostrzeżenie

Każdy, kto mieszka z przewlekłym stanem zdrowia, prawdopodobnie ma codzienną rutynę leków. Na szczęście istnieją produkty, które mogą złagodzić objawy, pomóc uniknąć poważnych sytuacji zdrowotnych i umożliwić stosunkowo normalne życie. Ale teraz Food & Drug Administration (FDA) wydało ostrzeżenie o jednym codziennym leku, o których możesz chcieć wiedzieć. Czytaj dalej, aby zobaczyć, który produkt jest ciągnięty z powodu potencjalnego zagrożenia dla zdrowia.
Powiązane: Te wspólne leki zgaga i bólu zostały właśnie odwołane, FDA ostrzega.
Mylan Pharmaceuticals wydał dobrowolne wycofanie jednej partii insuliny glargine.
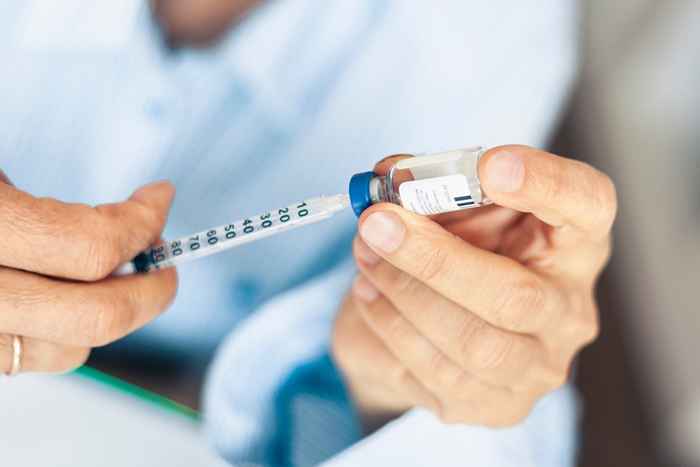
12 kwietnia FDA ogłosiła, że Mylan Pharmaceuticals Inc. dobrowolnie przywołuje jedną partię insuliny glargine (insulin glargine-yfGn), 100 jednostek/ml (U-100). Produkt jest pakowany w 10 ml fiolek zapakowanych w karton. Mylan Specjalność l.P. dystrybuował dotknięte produkty w U.S. między 9 grudnia 2021 r. a 4 marca 2022.
Przywołane elementy mogą być zidentyfikowane przez numer NDC 49502-393-80, numer partii BF21002800 i datę ważności sierpnia. 2023 wydrukowane na kartonie, w którym został wysłany. Ponadto zawiadomienie określa, że przywołanie wpływa na niezaprzeczoną fiolkę insuliny glargine-yfgn, a nie markowe wymienne biosimilarne semgle (insulinę glargine-yfgn).
Insulina jest przywoływana z powodu brakujących etykiet w niektórych fiolkach.

Zgodnie z zawiadomieniem Mylan Pharmaceuticals wydał insulinę wycofującą się po odkryciu, że danej partii może potencjalnie brakować etykiet w niektórych fiolkach. Może to stworzyć potencjalne zagrożenie dla zdrowia dla dorosłych i dzieci z cukrzycą typu 1 i typu 2, które codziennie używają leku w celu poprawy kontroli glikemicznej. AE0FCC31AE342FD3A1346EBBB1F342FCB
„W przypadku pacjentów otrzymujących leczenie więcej niż jednym rodzajem insuliny (e.G., Zarówno krótka, jak i długo działająca insulina), brakujący etykieta na fiolkach insuliny glargine może prowadzić do pomieszania produktów/mocnych stron, co może spowodować mniej optymalną kontrolę glikemii (wysoki lub niski poziom cukru we krwi), co może spowodować poważne powikłania , „ostrzega FDA.
Powiązane: Aby uzyskać więcej aktualnych informacji, zapisz się do naszego codziennego biuletynu.
Oto, co powinni zrobić hurtownicy dostaw medycznych i detaliści, jeśli mają wycofane fiolki.

FDA doradza wszystkim detalistom, aby zbadali swoje zapasy, aby natychmiast sprawdzić wycofany produkt. Jeśli coś zostanie znalezione, kwarantannie i zaprzestaj rozkładu partii.
Hurtownicy podaży medycznej powinny również zbadać swoje zapasy, kwarantannę i zaprzestanie dystrybucji wycofanego produktu. Powinny następnie powiadomić wszystkich klientów, którzy mogli otrzymać wycofany produkt, w tym klientów detalicznych. Lista wszystkich potencjalnych nabywców wycofanego produktu powinna być również dokonana na liście w pliku Microsoft Excel i wysłana pocztą elektroniczną do [e -maila] w ciągu pięciu dni roboczych. Sedgwick (STERICYCLE) wykorzysta te informacje, aby powiadomić klientów na poziomie detalicznym, którzy otrzymali dotkniętą partię.
Klienci z odwołanymi fiolkami powinni zadzwonić do STERICYCLE w celu uzyskania pakietu przesyłki zwrotnej.

Na szczęście, według FDA, nie zgłoszono jeszcze niekorzystnych zdarzeń medycznych związanych z wycofaniem. Jednak wszyscy klienci, którzy mają nieznakowane fiolki w posiadaniu, powinni zadzwonić do Stericycle pod numerem 1-888-912-7084, aby poprosić o pakiet dokumentacji, aby zwrócić produkt firmie.
W przypadku ogólnych pytań dotyczących wycofania klienci mogą zadzwonić do infolinii relacji z klientami na Vitris pod numerem 1-800-796-9526 w dni powszednie od 8 A.M. do 5 p.M. EST lub Wyślij wiadomość e -mail do [chroniona e -mailem] Agencja doradza również każdemu, kto mógł mieć problemy zdrowotne w wyniku skorzystania z wycofanego produktu, powinien od razu zadzwonić do lekarza lub lekarza.
Powiązane: Jeśli masz którykolwiek z tych 7 leków, przestań je teraz używać, FDA ostrzega.


